





Prepara tus exámenes y mejora tus resultados gracias a la gran cantidad de recursos disponibles en Docsity

Gana puntos ayudando a otros estudiantes o consíguelos activando un Plan Premium


Prepara tus exámenes
Prepara tus exámenes y mejora tus resultados gracias a la gran cantidad de recursos disponibles en Docsity
Prepara tus exámenes con los documentos que comparten otros estudiantes como tú en Docsity
Los mejores documentos en venta realizados por estudiantes que han terminado sus estudios
Estudia con lecciones y exámenes resueltos basados en los programas académicos de las mejores universidades
Responde a preguntas de exámenes reales y pon a prueba tu preparación

Consigue puntos base para descargar
Gana puntos ayudando a otros estudiantes o consíguelos activando un Plan Premium
Comunidad
Pide ayuda a la comunidad y resuelve tus dudas de estudio
Descubre las mejores universidades de tu país según los usuarios de Docsity
Ebooks gratuitos
Descarga nuestras guías gratuitas sobre técnicas de estudio, métodos para controlar la ansiedad y consejos para la tesis preparadas por los tutores de Docsity
PROYECTOS DE SEGUNDO CORTE, REALIZADOS A PARTIR DE APUNTES, EXÁMENES E INVESTIGACIONES
Tipo: Guías, Proyectos, Investigaciones
1 / 9

Esta página no es visible en la vista previa
¡No te pierdas las partes importantes!






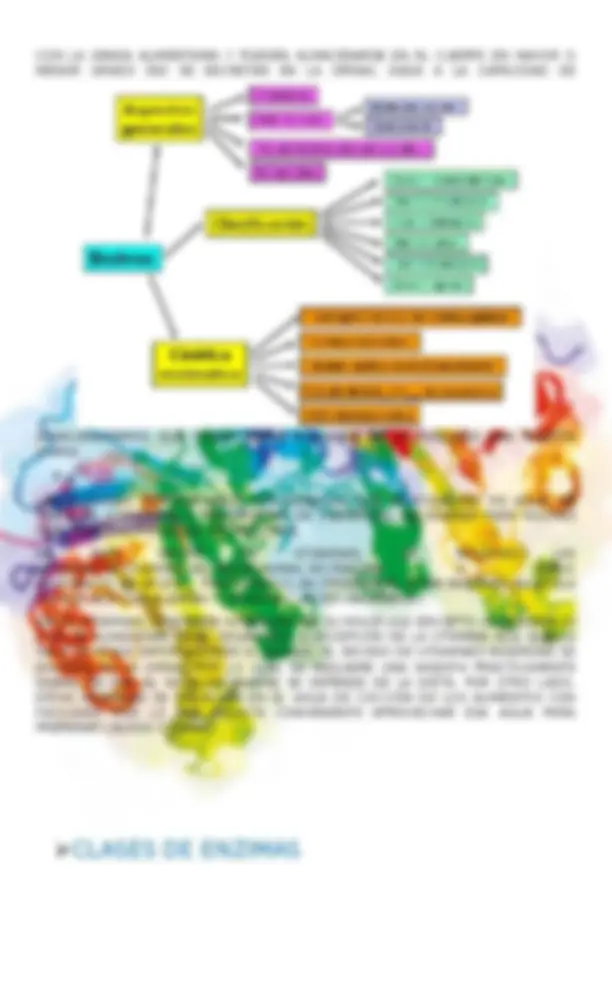
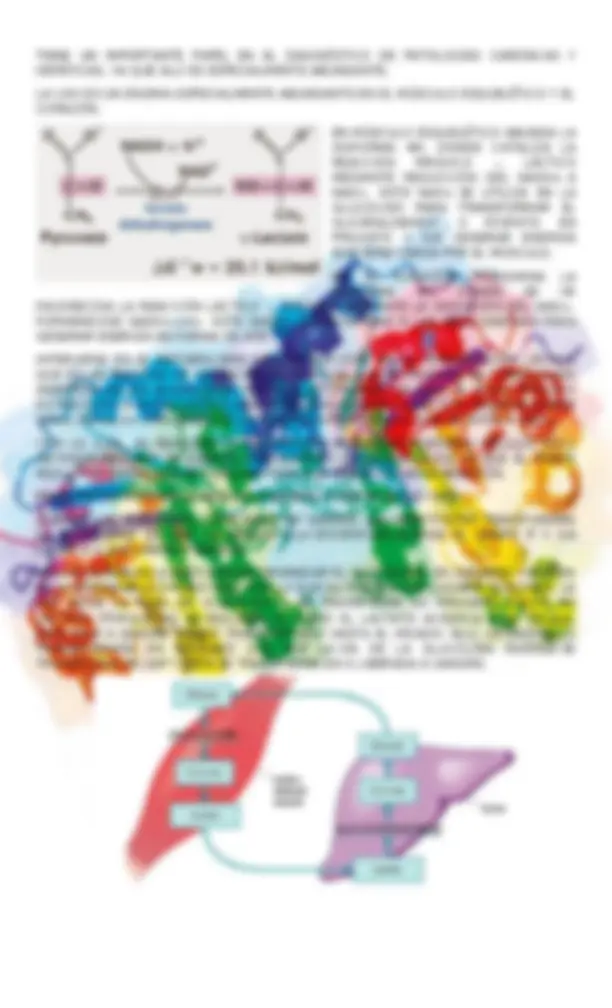
o VITAMINA A (RETINOLFTALINA) o VITAMINA D (CALCIFEROL) o VITAMINA E (TOCOFEROL) o VITAMINA K (ANTIHEMORRÁGICA) ESTAS VITAMINAS NO CONTIENEN NITRÓGENO, SON SOLUBLES EN GRASA, Y POR TANTO, SON TRANSPORTADAS EN LA GRASA DE LOS ALIMENTOS QUE LA CONTIENEN. POR OTRA PARTE, SON BASTANTE ESTABLES FRENTE AL CALOR (LA VITAMINA C SE DEGRADA A 90 °C EN OXALATOS TÓXICOS). SE ABSORBEN EN EL INTESTINO DELGADO